
Investigadores del IBEC y del CIBER-BBN liderados por la Profesora de investigación ICREA Núria Montserrat, en colaboración internacional, han identificado un fármaco capaz de bloquear los efectos del virus SARS-Co-V2, origen de la enfermedad del Coronavirus 2019.
El tratamiento, que desde hoy se podrá probar en doscientos pacientes de Covid-19, ha demostrado su eficacia en minirriñones generados a partir de células madre humanas. En estos organoides generados mediante técnicas de bioingeniería se ha descifrado cómo el SARS-Co-V2 interacciona e infecta las células humanas del riñón.
“El uso de organoides humanos nos permite probar de manera muy ágil los tratamientos que ya se están utilizando para otras enfermedades o que están cerca de ser validados. En estos momentos en los que el tiempo apremia, estas estructuras 3D ahorran drásticamente el tiempo que destinaríamos para probar un nuevo medicamento en humanos”, destaca las ventajas Núria Montserrat.
Publicaciones recientes han demostrado que, para infectar una célula, los coronavirus utilizan una proteína, denominada S, que se une a un receptor de las células humanas denominado ACE2 (enzima convertidora de angiotensina 2). Teniendo en cuenta que esta unión se ha detectado como puerta de entrada del virus al organismo, evitarla podría constituir una posible diana terapéutica.
Siguiendo esa estrategia, los investigadores se han centrado en entender el papel del receptor ACE2 en organoides humanos porque mimetizan en pocos milímetros muchas de las características de los órganos reales. El estudio proporciona nuevos conocimientos sobre aspectos clave del SARS-CoV-2 y sus interacciones a nivel celular, y también, sobre cómo el virus puede infectar los vasos sanguíneos y los riñones.
Además del pulmón, el receptor ACE2 también se expresa en otros tejidos, entre los que se incluye el corazón, los vasos sanguíneos, el intestino y los riñones, lo que explicaría la disfunción multiorgánica que se observa en los pacientes infectados por SARS-Co-V2. El hecho de que éste receptor se exprese fuertemente en los riñones y que el SARS-Co-V2 se puede encontrar en la orina, es lo que ha llevado a este equipo de investigadores a utilizar los organoides renales como modelo de prueba, de cuya creación Montserrat es referente internacional.
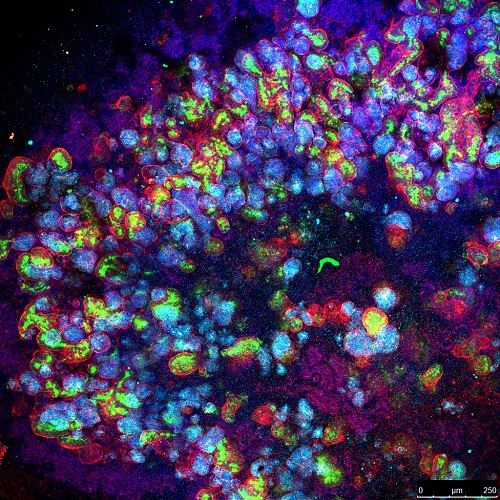 Imagen de microscopía confocal de un organoide de riñón generado in vitro a partir de células madre pluripotentes humanas que han sido diferenciadas durante 20 días usando cultivos tridimendionales. Estos organoides de riñón contienen estructuras renales que incluyen túbulos proximales (marcados con LTL, en verde) y la expresión de colágeno IV en la membrana basal (en rojo). Estas estructuras se asemejan en parte a las estructuras renales del riñón humano.
Imagen de microscopía confocal de un organoide de riñón generado in vitro a partir de células madre pluripotentes humanas que han sido diferenciadas durante 20 días usando cultivos tridimendionales. Estos organoides de riñón contienen estructuras renales que incluyen túbulos proximales (marcados con LTL, en verde) y la expresión de colágeno IV en la membrana basal (en rojo). Estas estructuras se asemejan en parte a las estructuras renales del riñón humano.En primer lugar los investigadores demostraron que los organoides renales contenían diferentes grupos de células que expresaban ACE2 de manera similar a la que se observa en el tejido nativo, y después, procedieron a infectarlo con SARS-CoV-2. Una vez obtuvieron estos minirriñones infectados, aplicaron diferentes terapias, concluyendo, como resultado del estudio, que el hrsACE2 (ACE2 humano recombinante soluble), un fármaco que ya ha superado las pruebas clínicas de fase 1 (en voluntarios sanos) y de fase 2 (en pacientes con síndrome de dificultad respiratoria aguda), inhibe significativamente las infecciones por SARS-CoV-2 y reduce su carga viral.
“Estos hallazgos son prometedores como un tratamiento capaz de detener la infección temprana del nuevo coronavirus que, a día 30 de marzo, ha afectado a más de 750,000 personas y se ha cobrado la vida de 36,000 personas en todo el mundo”, concluye Núria Montserrat.
Hallazgos como este ponen de manifiesto que las técnicas de bioingeniería son imprescindibles para la medicina del futuro. Hasta ahora, han permitido la creación de organoides y órganos en un chip, entre otros. Asimismo, la ingeniería molecular, que está muy ligada a la bioingeniería, lleva años demostrando su capacidad de prever la eficacia de tratamientos experimentales y reducir la experimentación con animales. Ahora, estas herramientas se ponen a disposición de la sociedad una vez más, para intentar hallar soluciones a la crisis provocada por el coronavirus.
Núria Montserrat lidera el grupo de Pluripotencia para la regeneración de órganos del IBEC y es miembro del CIBER-BBN, en este trabajo ha contado con la participación de las investigadoras Elena Garreta, Patricia Prado y Carmen Hurtado, entre otros.
*Imagen: microscopía confocal de un organoide de riñón generado in vitro a partir de células madre pluripotentes humanas que han sido diferenciadas durante 20 días usando cultivos tridimendionales. Estos organoides de riñón contienen estructuras renales que incluyen túbulos proximales (marcados con LTL, en verde) y la expresión de colágeno IV en la membrana basal (en rojo). Estas estructuras se asemejan en parte a las estructuras renales del riñón humano.
Monteil et al, Inhibition of SARS-CoV-2 infections in engineered human tissues using clinical-grade soluble human ACE2, Cell 2020, DOI: 10.1016/j.cell.2020.04.004